
News information
分类:行业资讯 发布时间:2023-06-01 访问量:898
T细胞免疫、体液免疫为人体提供了获得性免疫保护,两者分别通过TCR、BCR对识别特异性抗原。TCR识别经过内吞降解后通过MHC递呈的多肽复合物,即胞内靶点,BCR则识别胞外靶点。在转化研究方面,这也成为靶向治疗的核心,尤其是B细胞,抗体为分泌形式,以蛋白形式在创新药领域占据了重要地位。TCR则需要在T细胞膜上发挥作用,因此转化研究经历了更加漫长的过程。
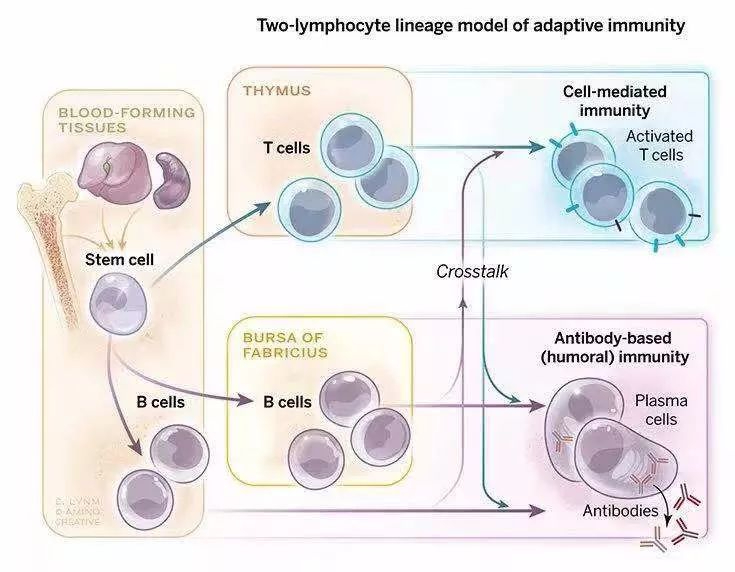
TCR方向,在CAR-T成功转化之后最自然的就是TCR-T的探索,尤其在实体瘤方面,陆续取得一些阶段性进展。
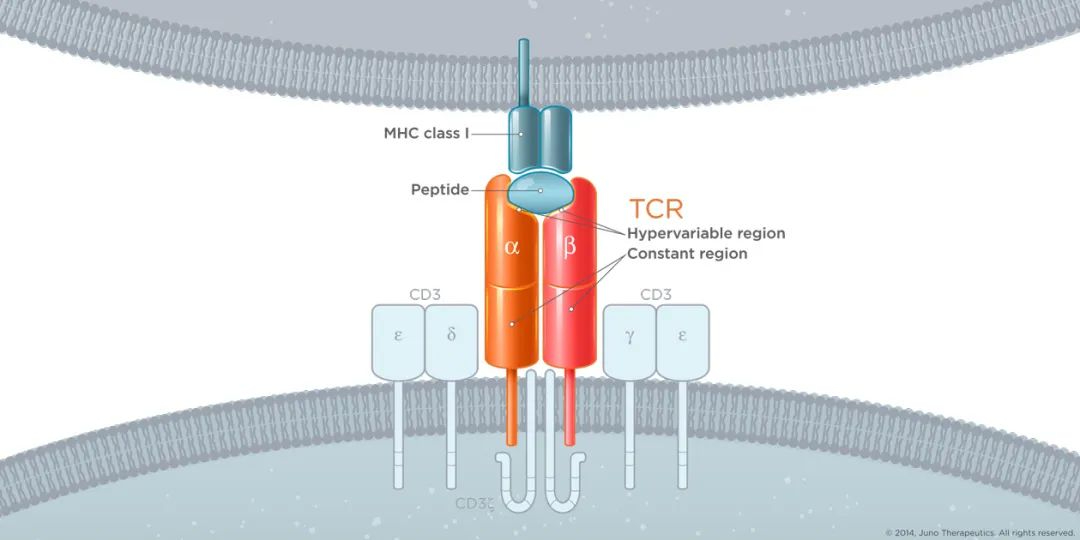
Adaptimmune、Immatics等的TCR-T疗法陆续在一些实体瘤初步临床中获得积极数据,如前不久Immatics的PRAME TCR-T在1b临床中获得64%的ORR。

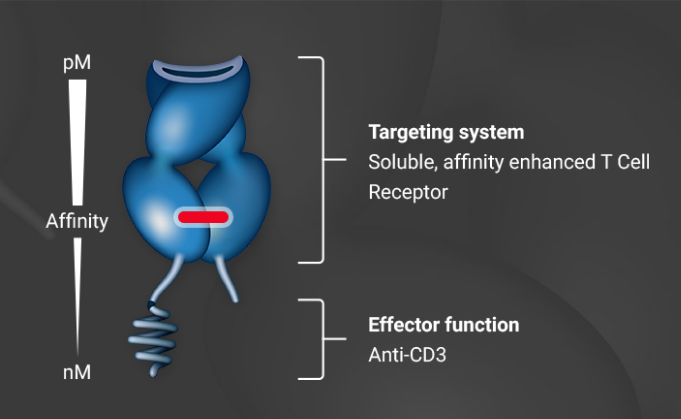
除了TCR-T之外,技术的不断发展让蛋白形式的TCR疗法,以及类TCR抗体也成为显示。ImmunoCore的ImmTAC技术平台,由抗CD3 scFv与TCR融合而成。TCR负责特异识别,抗CD3 scFv负责募集并激活T细胞。基于该技术平台的Kimmtrak已经获得FDA批准上市,用于治疗葡萄膜黑色素瘤。
此外,直接研发识别MHC/多肽复合物的抗体已经成为现实,可以模拟TCR的功能。如再生元的类TCR抗体技术PiG,在全人源抗体转基因小鼠基础上,人源化特定的HLA位点,如HLA-A2等。这样的小鼠由于免疫耐受不产生识别HLA-A2的抗体。然后免疫HLA-A2/多肽复合物,小鼠就会对HLA-A2/peptide产生特异性的抗体。
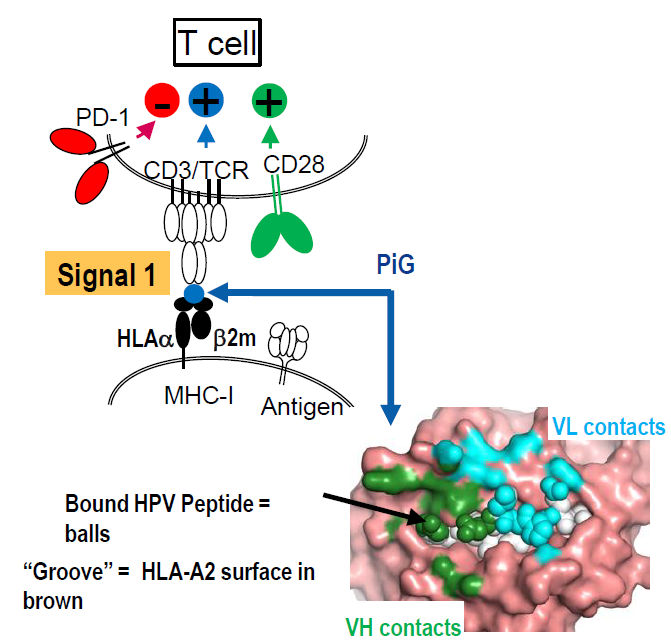
在PiG技术平台的技术上,再生元建立了FlexBiodies双抗技术平台,即类TCR/CD3双抗,CD3一侧负责募集T细胞,从而以双抗替代TCR-T发挥类似的功能。约翰霍普金斯大学医学院Zhou Shibin等也开发了类似的类TCR/CD3双抗。
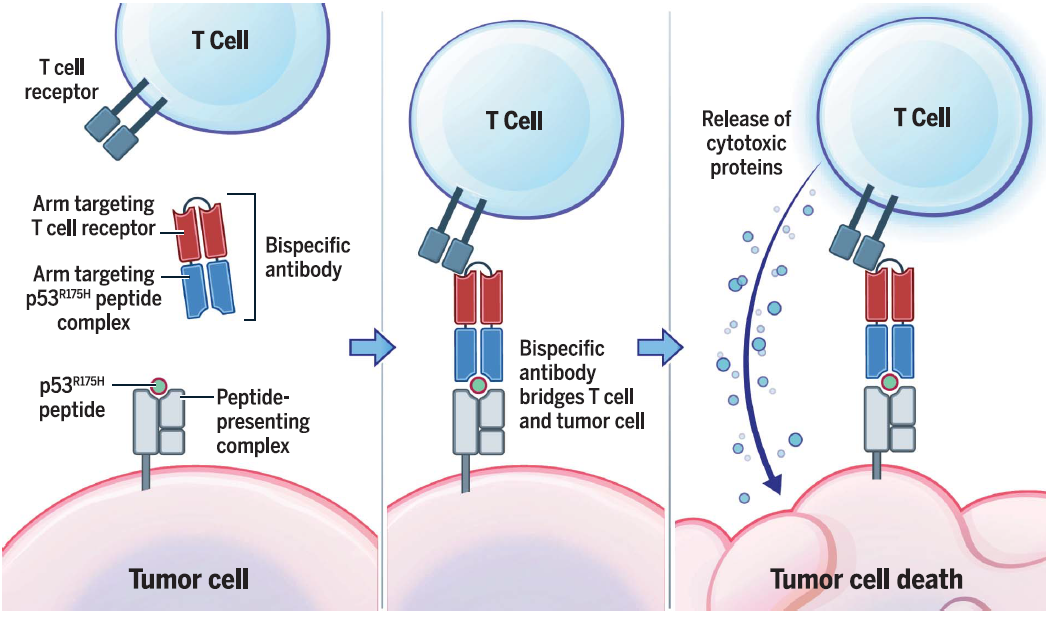
国内方面,智翔金泰、百奥赛图等也建立了类似的类TCR抗体技术平台。
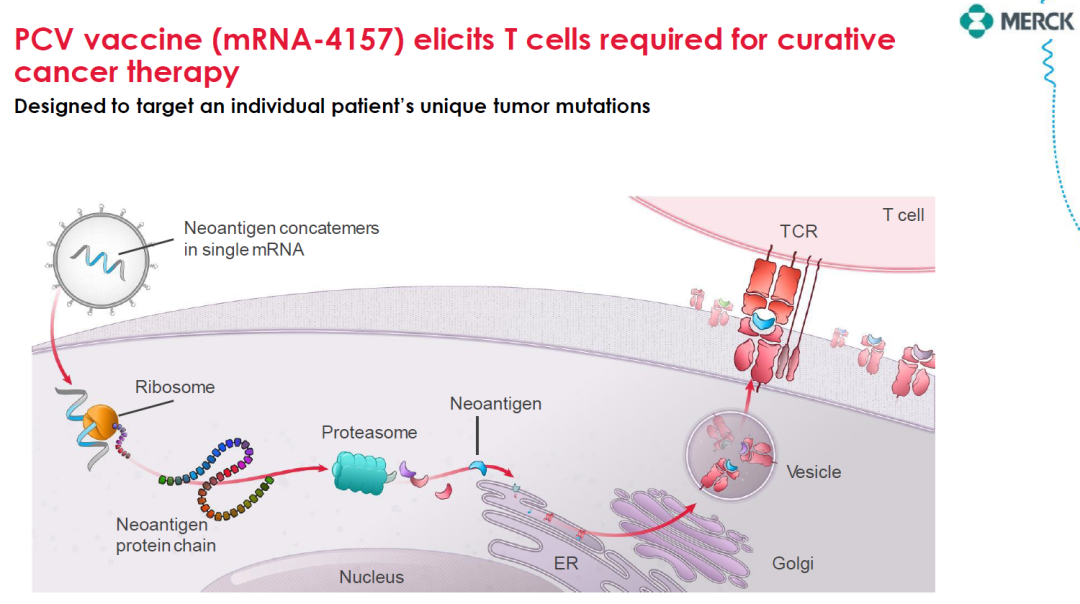
除此之外,肿瘤新抗原同样是围绕MHC/多肽复合物筛选患者个性化的neoantigen。2022年,Moderna/默沙东的肿瘤新抗原mRNA疫苗mRNA-4157取得重要进展,黑色素瘤辅助治疗的二期临床获得阳性数据,完整了重要的临床概念验证。
抗体的研发需要靶蛋白作为免疫原原,TCR疗法的研发则需要MHC/多肽复合物作为免疫原。恺佧生物可以提供高质量MHC多肽复合物系列产品,涵盖NY-ESO-1、MAGE-A、WT-1、AFP等热门靶点以及定制化产品,产品形式包括复合物单体、四聚体、生物素化四聚体及荧光标记的四聚体等,适合应用于免疫、筛选、亲和力研究、TCR流式检测等不同场景。
总结
TCR-T、TCR融合蛋白、类TCR抗体等多种药物形式,让TCR疗法的转化具备了更多工具。从机制上讲,此前的抗体疗法局限与胞外靶点,TCR疗法则打开了靶标的全新空间。相信未来几年,TCR-T疗法、类TCR抗体、肿瘤新抗原疫苗都将迎来更多临床突破。

国家医保部门从多个方面考虑到参保人员的利益,进而对相关政策进行调整和完善,提升居民的生活幸福感。

2020年-2025年,因新品上市以及患癌人数不断增加,因此从市场规模也随之上升。根据头豹研究院整理,ADC药物的市场规模预计在2024年有望达到74 亿元,2030年预计市场规模达到292亿元人民币,2024-2030年复合增长率为25.71%。

国家卫生健康委发布最新公告显示,2020年各类传播途径的甲乙类传染病发病率均呈现明显下降,其中肠道传染病发病率较2019年下降29.4%、呼吸道传染病发病率较2019年下降12.9%。因此,全球,包括中国在内的抗菌药物的使用额呈下降趋势。
随着新药的不断研发和政策的完善,渐冻症治疗市场有望迎来更加广阔的发展前景。