
News information
分类:行业资讯 发布时间:2023-04-07 访问量:428
抗体是一类能与抗原特异性结合的免疫球蛋白, 人血清中总共存在5种抗体,其中免疫球蛋白G(IgG)类含量最多,约占总抗体的70-85%。自1997年第一个抗肿瘤药物利妥昔单抗首次获批以来,抗体领域得到快速发展,基于抗体开发了各种药物如抗体药物偶联物(ADC)以及双特异性抗体(bsAb)等。
本文主要介绍IgG在抗体药物,如单抗,bsAb和ADC设计中亚型改如何选择。
IgG的四种亚型有什么区别?
人的IgG包括:IgG1、IgG2、IgG3、IgG4四个亚型,虽然所有的亚型在氨基酸水平上超过90%的同一性,但每个亚型在铰链区长度、链间二硫键数量和Fc效应功能方面都有独特的特性(表1)。
表1. 人IgG亚类和与主要FcγR的结合亲和力(x105 M_1)
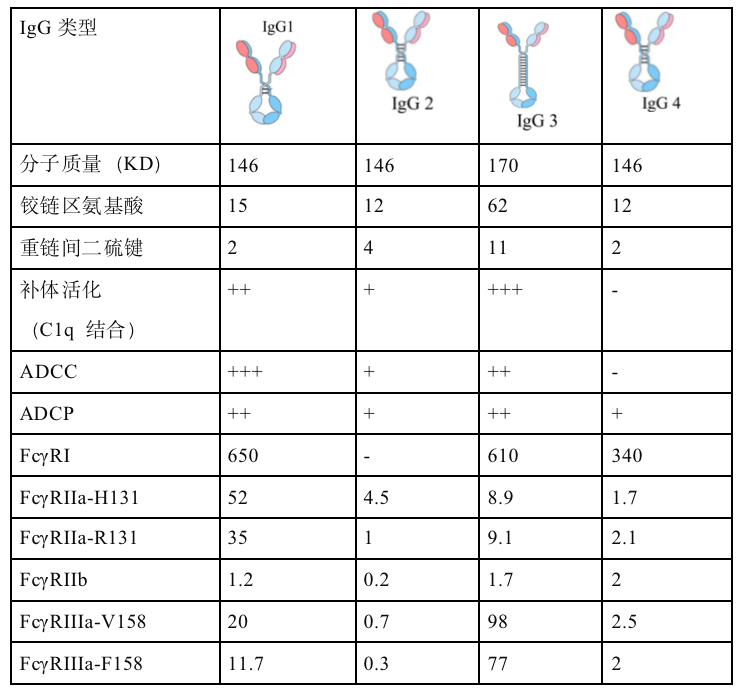
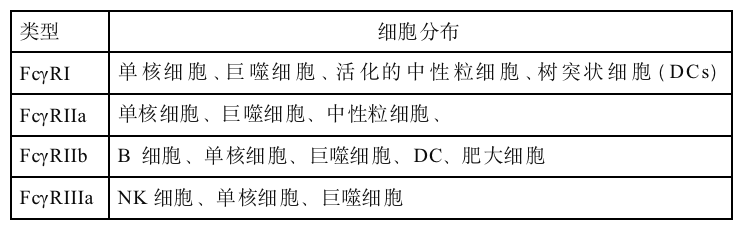
IgG1与FcγR 亲和力最高,具有最强的ADCC效应,其次分别是IgG3、IgG2和IgG4。FcγR包括6种亚型(FcγRI、FcγRIIA、FcγRIIB、FcγRIIC、FcγRIIIA、FcγRIIIB),它们在细胞分布与Fc的亲和力以及由此产生的生物活性方面存在差异(表2)。
在所有FcγR亚类中,FcγRIIIA主要在NK细胞表达,所以主要介导ADCC,FcγRIIA主要在巨噬细胞表达,所以主要介导ADCP。
表2. 主要人类FcγR的细胞分布
IgG亚型的选择——单靶点抗体
单靶点抗肿瘤抗体一直较为热门,虽然单靶点抗体的IgG亚型选择没有严格的标准,但应考虑靶点的细胞分布和生物学功能。
FDA批准的抗肿瘤抗体药物中绝大多数都选择了IgG1类型,如西妥昔单抗,曲妥珠单抗,Atezolizumab、Durvalumab和Avelumab等,这类药物可以在行使阻断肿瘤生长信号(EGFR),抑制血管的生成(VEGFR)和激活免疫细胞(PD-L1)等功能的同时,通过ADCC/CDC作用杀伤消除肿瘤细胞,从而进一步增强抗肿瘤效应。
对于靶点在免疫细胞上的抗肿瘤IgG亚型选择较复杂,一些靶点向免疫细胞传导抑制/促进信号来调节免疫功能。这些抑制信号统称为抑制性受体(如CTLA-4、PD-1、TIM-3和LAG-3),促进信号(4-1BB、CD40、OX40、CD27和GITR等)称为免疫刺激受体。
3.2.2 当这些抑制性受体靶点主要表达于促进肿瘤生长或是免疫抑制性的细胞上时,应首选IgG1类型。因为IgG1可通过ADCC/ADCP机制将肿瘤微环境中的免疫抑制型细胞清除,从而更好的杀伤肿瘤。如依匹单抗(Ipilimumab)选择了IgG1类型来清除CTLA-4表达的Treg细胞。
3.2.3 免疫刺激受体类抗体IgG在选择上更为复杂,需要考虑的因素更多。大多数免疫刺激型受体属于肿瘤坏死因子超家族(如4-1BB,CD40,OX40,CD27,GITR),抗肿瘤活性依赖于Fc与FcγR的交联。特别是FcγRIIB,作为支架促进抗体多聚化,多聚化会促进受体聚集,这是激活下游细胞内信号传导的先决条件。进一步优化抗TNFR超家族成员抗体的抗肿瘤活性的方法是工程化抗体的Fc区以改善其FcγRIIB接合。
IgG亚型的选择——双特异性抗体
双特异性抗体(bsAb)在单个抗体中含有两个靶标结合单元,表现出两种不同的Fab(抗原结合片段)状态。它充当具有不同作用模式的两种抗原之间的桥梁。bsAb 分为两种类型,含有片段可结晶(Fc)状态(包括两种形式Triomab和Duobody)和无Fc状态的基于单链可变片段(scFv)的双特异性 T 细胞接合器BiTE(图3)。
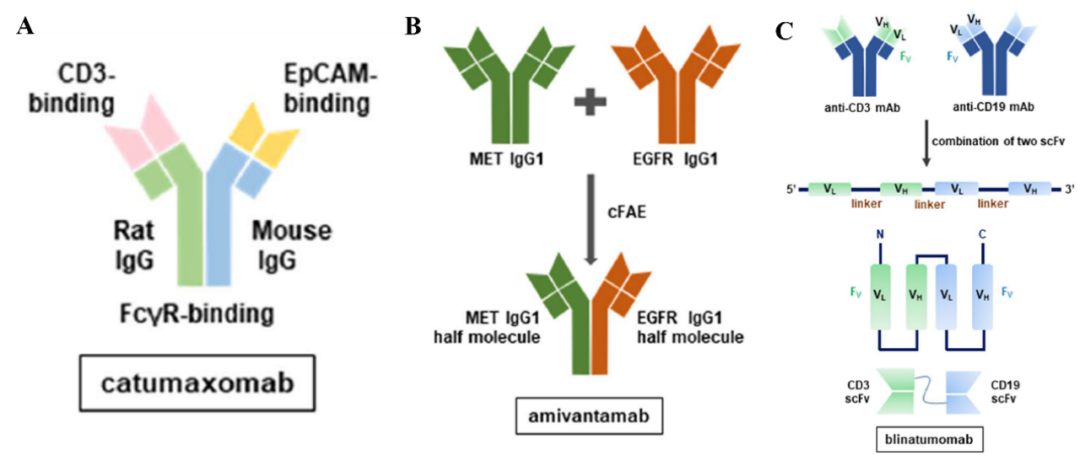
图3. bsAb的类型
双特异性抗体与单抗相比增加了一个特异性抗原结合位点,特异性更强、更能准确靶向肿瘤细胞以及降低脱靶毒性。
因此对于BsAb开发的靶点药物以及IgG类型的选择就变得更为复杂,需考虑以下几点:
a. 靶点的生物协同作用;b. 靶点的细胞分布;c. Fc段介导的生物学功能(ADCC/CDC)。
4.1 当双靶点靶向肿瘤细胞的两个不同受体时与单靶点要考虑的因素基本相同,应首选IgG1,IgG1的Fc段介导的ADCC/CDC对肿瘤的作用;
4.2 对于靶点位于免疫细胞时考虑的因素首先应确定靶向的免疫细胞的种类(效应或抑制),当靶点均位于效应性免疫细胞时,则应选用IgG2或IgG4量减少或避免Fc端介导的ADCC/ADCP效应;反之,当靶点均位于抑制免疫细胞时则首先应考虑IgG1以清除免疫抑制细胞。如果抗体的靶点分别位于抑制和效应细胞的双特异性抗体时,则具有一定的难度,因为这两个靶点抗体的作用相悖,无论选择哪种类型的IgG 都难平衡两端的关系。
图4列出了对于双特异性抗体拟选IgG亚型种类。
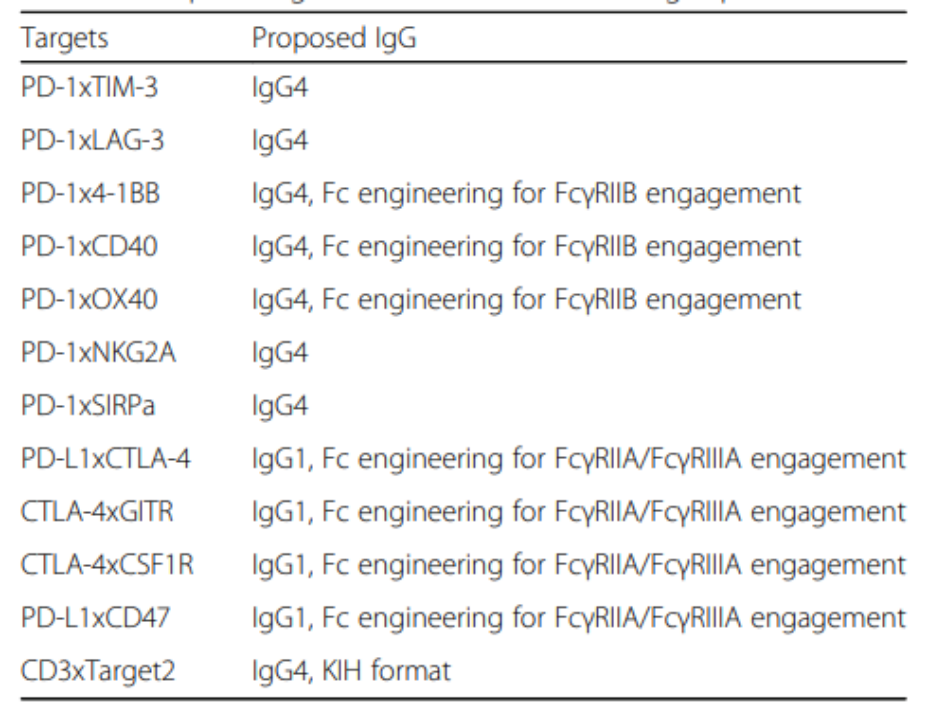 图4. 双特异性抗体的拟议IgG亚类
图4. 双特异性抗体的拟议IgG亚类
IgG亚型的选择——ADC
由于抗体种类最丰富,并且有启动免疫效应的效力,IgG被用于ADC开发,逐步从早期lgG4转向lgG1。
所以目前用于ADC开发最常见的抗体类型是IgG1,被FDA批准上市的14个ADC中只有两款ADC药物选择IgG4,其余都选择IgG1抗体。
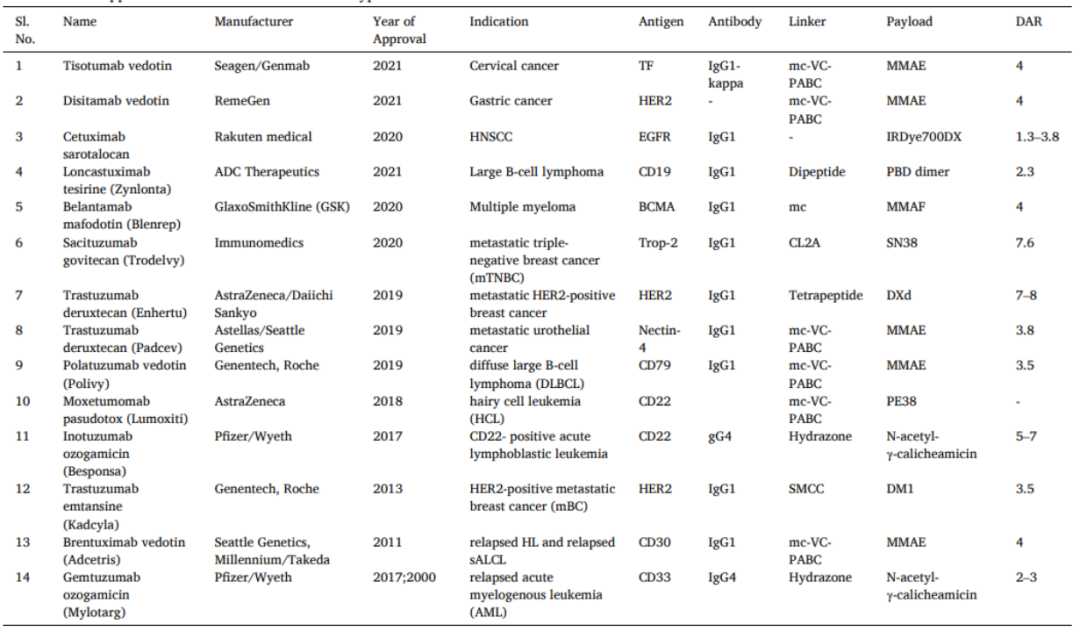 图5. FDA批准的用于治疗不同类型癌症的ADC
图5. FDA批准的用于治疗不同类型癌症的ADC
内化是另一个有助于提高ADC的功效主要因素。
特别是在实体瘤的情况下,抗体在体循环中应具有较长的半衰期和高稳定性,以通过保留和通透性有效地到达肿瘤部位。
解离常数(Kd)是影响ADC内化入癌细胞的主要因素。
为了获得令人满意的功效,ADC应均匀分布在整个肿瘤中,ADC分布不均可能导致疗效不理想。Kd越低,肿瘤细胞表面存在的抗体与新生儿Fc受体(FcRn)之间的结合亲和力就越高,导致疗效低下。所以理想情况下,Kd应较高,才能有效渗透并均匀分布在整个肿瘤细胞中。
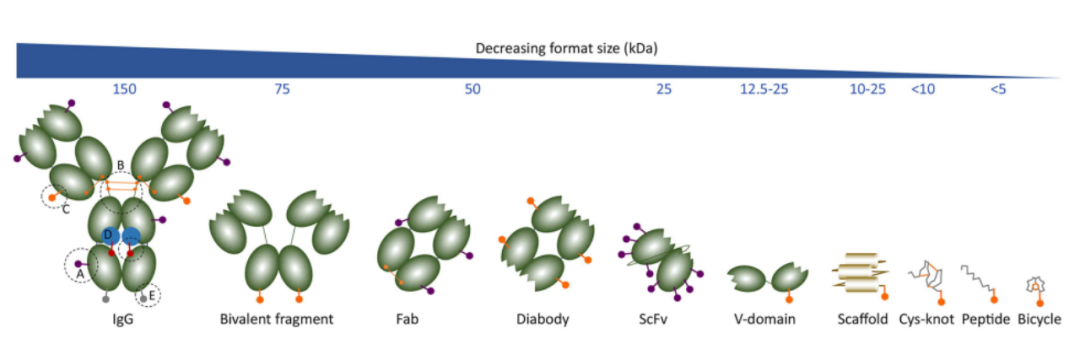
此外,抗体的分子量是影响ADC进入肿瘤细胞的另一个关键因素。
IgG抗体的分子量约为150千道尔顿(KDa)。由于高分子量,ADC穿透血管并到达肿瘤部位成为具有挑战性的部分。因此,应考虑较小的抗体尺寸实现理想的ADC开发(图6)。
小结
抗肿瘤抗体不仅可以通过多种方式发挥它们的功能,包括靶标调控、中和可溶性靶标、破坏配体-受体互作以影响细胞信号转导、与免疫效应功能衔接等,还可以用来设计药物偶联物,包括抗体药物偶联物(ADC),肽-药物偶联物(PDC),多肽-药物偶联物(polyDC),小分子药物偶联物(SMDC)、免疫刺激抗体偶联物(ISAC)、抗体片段药物偶联物(FDC)和适体药物偶联物(ApDC)等。
抗体的作用机制影响着它的临床应用及开发潜能,为达到期望的治疗效果并且避免不良反应,在开发前首先考虑抗体亚型的选择显得越来越重要,在抗体的设计和开发过程中,必要考虑的因素包括:抗体的理化性质(溶解度、均一性、结构稳定性)、生物活性(中和活性)、抗体亚型、效应功能、独特的生物学特性、对应的表达细胞以及抗体药物最终的药效机制等。

国家医保部门从多个方面考虑到参保人员的利益,进而对相关政策进行调整和完善,提升居民的生活幸福感。

2020年-2025年,因新品上市以及患癌人数不断增加,因此从市场规模也随之上升。根据头豹研究院整理,ADC药物的市场规模预计在2024年有望达到74 亿元,2030年预计市场规模达到292亿元人民币,2024-2030年复合增长率为25.71%。

国家卫生健康委发布最新公告显示,2020年各类传播途径的甲乙类传染病发病率均呈现明显下降,其中肠道传染病发病率较2019年下降29.4%、呼吸道传染病发病率较2019年下降12.9%。因此,全球,包括中国在内的抗菌药物的使用额呈下降趋势。
随着新药的不断研发和政策的完善,渐冻症治疗市场有望迎来更加广阔的发展前景。